THÉMATIQUES DE RECHERCHE FINANCÉES
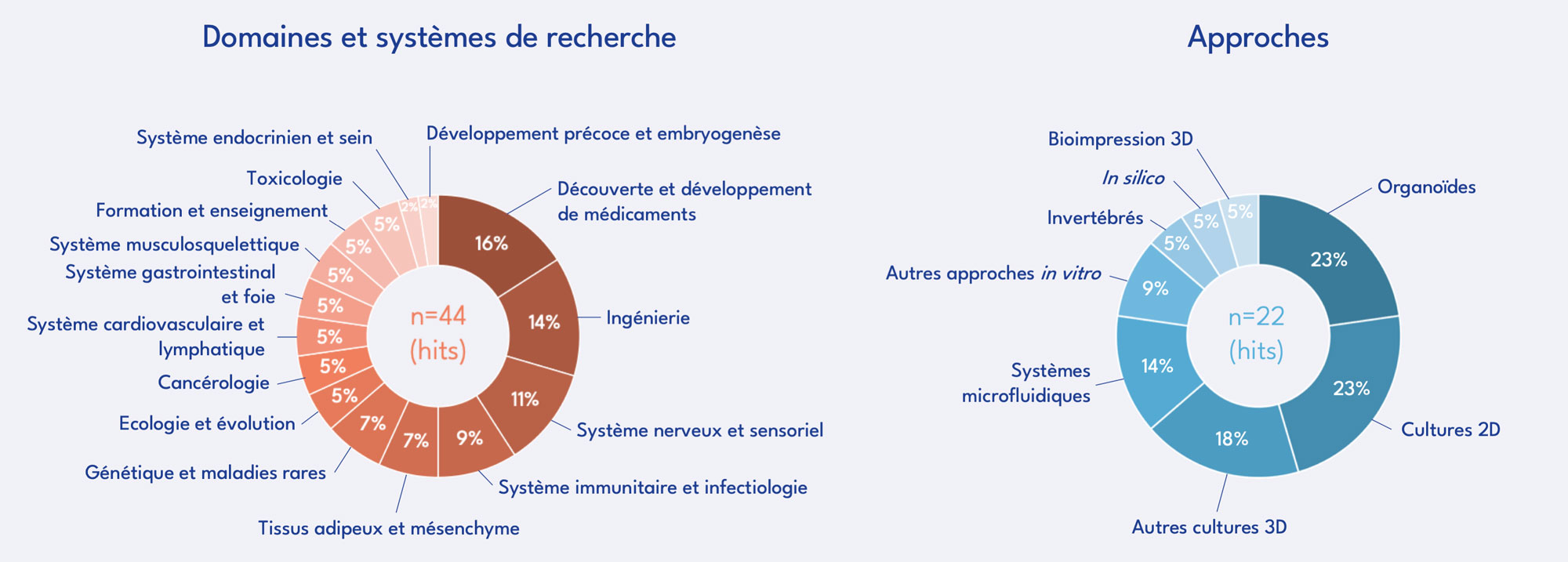
Appel à projets du FC3R – Résultats publiés en avril 2025
Par cet appel à projets, le FC3R a souhaité valoriser des projets innovants et coopératifs, proposant une nouvelle stratégie, méthode ou technologie favorisant le Remplacement – total, relatif ou partiel – des animaux utilisés à des fins scientifiques : développement de méthodes alternatives in vitro, in silico ou in chemico ou remplacement de sous-produits d’origine animale (sérum fœtal de veau, extraits de membranes basales, anticorps), mais aussi élaboration de programmes de formation, optimisation de méthodes existantes ou mise en place de dispositifs pour faciliter le partage (ressources, protocoles, données expérimentales) et le transfert de connaissances pour faciliter l’adoption et la dissémination de ces approches au sein de la communauté scientifique.
101 projets ont été déposés dans le cadre de cet AAP. Le Comité Scientifique en a sélectionné 15 pour un financement total par le FC3R de 699 500 €.

3D-DISC : Developpement d'un modele 3d de disque intervertebral pour l'évaluation de thérapies régénératrices.
Résumé :
Le mal de dos, principale cause d'invalidité à l'échelle mondiale, est principalement liée à la dégénérescence des disques intervertébraux. Les traitements actuels, tels que anti-douleurs et approche chirurgicale, ne traitent pas les processus biologiques dégénératifs. A l’inverse, la médecine régénératrice vise à ralentir ces processus et à rétablir un disque sain. Afin de réduire l’utilisation de modèle animaux pour l’évaluation de ces nouvelles thérapies, le projet 3D-DISC va développer un modèle de disque intervertébral grâce à la technologie de biofabrication. Nous comparerons dans ce modèle in vitro la capacité de cellules et de vésicules extracellulaires à ralentir le processus de dégénerescence.
Projet est porté par : Catherine LE VISAGE.
Financement attribué :
Le projet 3D-DISC se voit attribuer un financement de 48 500 €.
3D-MICROTECH : Promouvoir l’Hétérogénéité Microenvironnementale en Culture Cellulaire 3D : Approches Techniques et Formation.
Résumé :
Deux-tiers des molécules candidates anticancéreuses qui fonctionnent chez la souris échouent lors des essais sur les humains. De plus, la résistance aux traitements pourtant validés reste un défi majeur chez les patients. La solution à ces problèmes est en grande partie liée à la possibilité de reproduire l’hétérogénéité du cancer originel, avec des zones tumorales non identiques qui favorisent l’agressivité des tumeurs. Notre projet innovateur porte (1) sur le développement de modèles de culture de cellules humaines qui reproduisent l’hétérogénéité tumorale en agissant sur l’environnement dans lequel les cellules cancéreuses subsistent, et (2) sur une formation théorique et pratique sur la production de tumeurs au laboratoire qui sont conformes à la réalité. Ce projet sera valorisé dans le monde scientifique et clinique tout en respectant le monde animal.
Projet est porté par : Sophie LELIèVRE.
Financement attribué :
Le projet 3D-MICROTECH se voit attribuer un financement de 48 500 €.
A-CELLHERD : Réalisation d'un troupeau cellulaire de cellules souches pluripotentes porcines pour des approches de génétique cellulaire.
Résumé :
Les changements globaux actuels nous obligent à repenser nos systèmes d’élevage pour réduire la pression sur les écosystèmes, augmenter la sécurité alimentaire et sanitaire et mieux prendre en considération le bien-être animal. Pour cela, nous utilisons des leviers (génétique, nutritionnel ou environnementaux) qui nous permettent de mieux adapter les animaux d’élevage à ces nouveaux objectifs. Mais pour les actionner efficacement, il est nécessaire de pouvoir prédire leurs effets sur les animaux. Pour cela et afin d’éviter de recourir à des prélèvements invasifs et à l’expérimentation animale, nous proposons de remplacer les animaux par des troupeaux de lignées cellulaires pluripotentes. Ces cellules permettent de produire in vitro différents tissus et mini-organes et facilitent notamment l’étude des caractères de santé ou de nutrition en lien avec les facteurs génétiques, nutritionnels et environnementaux.
Projet est porté par : Hervé ACLOQUE.
Financement attribué :
Le projet A-CELLHERD se voit attribuer un financement de 39 000 €.
Adiponet : Organoïdes de tissus adipeux humain: Développement et Standardisation des méthodes de congélation/décongélation et mise en culture pour les biobanques.
Résumé :
Les maladies métaboliques et les maladies inflammatoires chroniques de l’intestin ont conquis le monde ces dernières décennies, avec l’occidentalisation du mode de vie et des habitudes alimentaires. Un facteur commun à ses pathologies serait le rôle joué par le tissu adipeux dans le contrôle du métabolisme et l’inflammation dans ses pathologies. La recherche utilise des milliers de souris chaque année pour élucider ce rôle, mais on sait que le tissu adipeux de ces animaux est différent de celui de l’Homme. Le projet AdipoNet vise à créer une procédure pour congeler/décongeler du tissu adipeux humains permettant son transport et les échanges entre laboratoires, mais aussi la culture de tissu adipeux à partir de tissus de patients décongelés, et l’établissement de biobanques pour la recherche médicale à partir de ces cultures.
Projet est porté par : Anne BOULOUMIE.
Financement attribué :
Le projet Adiponet se voit attribuer un financement de 48 500 €.
CARDIOCELL : Les cellules iPSC dérivées de cardiomyocytes de patients : un nouveau modèle cellulaire pour le traitement de la dysfonction sinusale.
Résumé :
Pour les chercheurs, la technologie des cellules souches humaines pluripotentes induites (IPS) constitue un outil unique pour modéliser et étudier certaines pathologies. Cette approche consiste à faire différencier, in vitro, des cellules IPS en différents types cellulaires. Elle présente l’immense avantage de reproduire une pathologie dans une boite de Pétri sans avoir recours aux modèles animaux. Notre objectif principal est d’utiliser ce modèle unique de pathologie « en boite de pétri » pour comprendre le génome du patient, son fonctionnement cellulaire afin d’identifier de nouvelles approches thérapeutiques pour traiter la dysfonction sinusale symptomatique. Cette pathologie cardiaque est la forme la plus commune de bradycardie. Chaque année, elle induit l’implantation de plus de 500 000 pacemakers électroniques en Europe et aux Etats-Unis.
Projet est porté par : Pietro MESIRCA.
Financement attribué :
Le projet CARDIOCELL se voit attribuer un financement de 48 500 €.
CellMorphTox : Morphologie cellulaire pour évaluer le risque de toxicité d’une molécule chimique.
Résumé :
Grâce à des techniques innovantes d’imagerie de cellules marquées par fluorescence, telles que la ‘Cell Painting’, il est possible d’analyser les changements morphologiques des cellules induits par l’exposition à une molécule chimique, de façon systématique, ouvrant la voie à des campagnes de criblages de librairies de composés chimiques. Dans ce cadre, le projet CellMorphTox vise à collecter ce type de données et développer une méthode informatique permettant d’identifier une ‘signature’ de morphologie cellulaire pour un ensemble de composés partageant un même profil phénotypique néfaste pour la santé humaine. Cet outil sera accessible à la communauté scientifique via une plateforme en ligne et contribuera à réduire des tests sur animaux, en suivant les principes des 3R (Remplacement, Réduction, Raffinement). Il pourra guider les autorités dans l’évaluation des risques chimiques futurs.
Projet est porté par : Olivier TABOUREAU.
Financement attribué :
Le projet CellMorphTox se voit attribuer un financement de 48 500 €.
FELINT : Nouveaux modèles cellulaires pour mieux comprendre les interactions spécifiques entre T. gondii et son hôte définitif félin.
Résumé :
La toxoplasmose est une maladie zoonotique qui a des conséquences graves chez les immunodéprimés et le fœtus lors de primo-infection chez la femme enceinte. Le parasite responsable, Toxoplasma gondii, peut infecter tous les animaux à sang chaud mais c’est uniquement chez le chat qu’a lieu sa reproduction sexuée, aboutissant à l’excrétion fécale de parasites infectieux dans l’environnement, responsables de contaminations animales et humaines. Ainsi, il est essentiel d’élaborer de nouvelles stratégies efficaces contre cette infection chez les chats afin de bloquer l’excrétion du parasite et protéger ainsi l’environnement et la santé publique. Notre projet de recherche propose de développer puis d’utiliser de nouvelles approches de culture cellulaire alternatives à l’utilisation d’animaux, pour augmenter les connaissances sur le cycle de vie de T. gondii chez le chat dans cette perspective.
Projet est porté par : Delphine LE ROUX.
Financement attribué :
Le projet FELINT se voit attribuer un financement de 35 000 €.
GlioTumoroids : Organoïdes cortico-endothéliaux humains pour l'étude in vitro de la physiopathologie du glioblastome.
Résumé :
Le glioblastome (GB) est une tumeur cérébrale agressive à pronostic défavorable, dont les interactions avec l’environnement cellulaire du cerveau restent mal comprises. Traditionnellement, l’étude du GB repose sur des modèles murins, une approche coûteuse, chronophage et soulevant des questions éthiques. Ce projet propose une alternative in vitro innovante: un système organoïde combinant des cellules corticales et endothéliales humaines (CO+EO), qui reproduit les tissus cérébraux vascularisés. Grâce à ce modèle, nous étudierons l’interaction des cellules GB avec différents types de tissus et le rôle du gène CELF2 dans l’agressivité tumorale. Cette recherche vise à décrypter les mécanismes moléculaires influençant la migration et la croissance du GB, ouvrant la voie à de nouveaux traitements tout en réduisant l’utilisation de modèles animaux.
Projet est porté par : Michele BERTACCHI.
Financement attribué :
Le projet GlioTumoroids se voit attribuer un financement de 48 500 €.
Habemuscl : Plateforme préclinique avancée basée sur l'humain pour la modélisation des maladies neuromusculaires.
Résumé :
Les maladies neuromusculaires (MNM), telles que les dystrophies musculaires, manquent de modèles précliniques efficaces pour étudier leurs mécanismes et tester les traitements. Bien que les modèles animaux aient été utilisés pendant des décennies, ils ne reflètent pas toujours fidèlement les conditions humaines, ce qui entraîne des échecs dans les essais cliniques. Les modèles cellulaires humains sont une alternative prometteuse, mais leur maturation est souvent insuffisante. Ce projet vise à créer une plateforme avancée, humaine, pour modéliser les tissus musculaires. En combinant cultures cellulaires 2D et 3D avec stimulations électriques et mécaniques, nous développerons un dispositif tout-en-un pour l'analyse des modèles musculaires, utilisés pour l’étude des MNM, les tests de médicaments et la médecine personnalisée, réduisant ainsi le besoin de modèles animaux et les coûts de la recherche.
Projet est porté par : Stefano TESTA.
Financement attribué :
Le projet Habemuscl se voit attribuer un financement de 45 000 €.
HOBIT : Rythme biologique intrinsèque des organoïdes hépatiques.
Résumé :
Les rythmes circadiens jouent un rôle physiologique central et proviennent de l'horloge circadienne (HC) présente dans toutes les cellules du corps. Perturbée dans les maladies métaboliques, l’HC est essentielle à la santé du foie. Les cellules souches pluripotentes humaines induites (hiPSCs) dérivées en organoïdes hépatiques apparaissent comme une alternative expérimentale afin d’améliorer la transférabilité des résultats précliniques à l'Homme. Cependant, nous ne connaissons rien de leurs propriétés circadiennes. En utilisant un protocole exempt de dérivés animaux, notre projet caractérisera précisément les caractéristiques temporelles et circadiennes des hiPSCs dérivées en organoïdes hépatiques synchronisés. Ce projet (1) rendra les organoïdes hépatiques plus pertinent d'un point de vue physiologique, (2) réduira le nombre d'animaux utilisés dans la recherche pharmacologique et (3) sera un grand atout pour améliorer la médecine de précision et personnalisée.
Projet est porté par : Daniel MAUVOISIN.
Financement attribué :
Le projet HOBIT se voit attribuer un financement de 48 500 €.
ICOPRIM : Optimisation des organoïdes cérébelleux pour une modélisation robuste de pathologies.
Résumé :
Le cervelet, connu pour son rôle dans la coordination motrice, joue également un rôle essentiel dans la mémoire, le langage et les émotions. Les malformations congénitales du cervelet sont associées à divers troubles neurodéveloppementaux, qui constituent le cœur de notre recherche. Malgré les progrès en génétique, de nombreux cas restent inexpliqués et aucune thérapie n’est actuellement disponible. Pour y remédier, nous développons des modèles in vitro issus de cellules souches, appelés organoïdes, qui imitent le développement précoce du cervelet humain. Notre projet vise à accroître la fiabilité, la précision et la robustesse de ces modèles et en faire une alternative aux modèles animaux, pour mieux comprendre maladies du cervelet et ouvrir la voie à des thérapies ciblées.
Projet est porté par : Marion COOLEN.
Financement attribué :
Le projet ICOPRIM se voit attribuer un financement de 48 500 €.
MINIBRAIN : Modéliser les neurodégénérescences humaines sur puce pour réussir le transfert clinique de candidats médicaments.
Résumé :
Les maladies neurodégénératives atteignent des niveaux épidémiques dans les pays industrialisés, affectant déjà plus de 7 millions de personnes en Europe. Et pourtant, il n’existe toujours aucune thérapie efficace. Le développement de médicaments fait face à des défis majeurs, car les tests traditionnels sur animaux ont une faible valeur prédictive pour l’Homme. Les progrès sur les cellules souches humaines, combinés aux microsystèmes organes-sur-puce, offrent de nouvelles perspectives très prometteuses. En reproduisant un tissu humain à l’échelle microscopique, ces systèmes améliorent la pertinence physiologique des modèles actuels, tout en offrant des alternatives crédibles à l’expérimentation animale. Notre laboratoire est pionnier dans la conception de modèles cerveau-sur-puce. Le projet MINIBAIN propose désormais de développer une nouvelle génération de dispositifs humanisés, pour une recherche pharmaceutique plus efficace et plus éthique.
Projet est porté par : Maxime CAZORLA.
Financement attribué :
Le projet MINIBRAIN se voit attribuer un financement de 47 000 €.
OBANI : Obtention d’anticorps pour l’immunohistochimie et le western blotting sans animaux.
Résumé :
Le phage display : une méthode innovante pour développer des anticorps spécifiques Le phage display est une technologie moderne qui permet de produire rapidement des anticorps ciblant des protéines dénaturées, comme celles analysées en immunohistochimie ou western blot. Elle utilise des bactériophages (virus) modifiés pour afficher des anticorps à leur surface, permettant une sélection directe et précise contre les épitopes linéaires des protéines dénaturées. Cette méthode est rapide, évite l’utilisation d’animaux, et offre une grande flexibilité pour s’adapter aux conditions expérimentales spécifiques. Les anticorps ainsi générés sont hautement spécifiques, efficaces, et peuvent être optimisés pour répondre aux besoins de la recherche ou du diagnostic. Le phage display est donc une solution éthique et puissante pour développer des outils fiables et adaptés à la détection des protéines en milieu dénaturant.
Projet est porté par : Pierre MARTINEAU.
Financement attribué :
Le projet OBANI se voit attribuer un financement de 48 500 €.
Optimello : Optimiser l’utilisation de la larve Galleria mellonella comme modèle alternatif d’infection pour des bactéries pathogènes.
Résumé :
Le projet Optimello explore le potentiel de Galleria mellonella (Gm) comme alternative aux animaux vertébrés dans la recherche sur les infections bactériennes. Respectant les principes des 3R (Remplacer, Réduire, Raffiner), ce modèle facile à maintenir est rentable, éthique et évolutif. Gm présente un système immunitaire inné similaire à celui des humains. Optimello vise trois objectifs : produire un génome de Gm complet et annoté, établir une carte des interactions hôte-pathogène via des études transcriptomiques, et créer une plateforme en ligne pour partager les données et standardiser les protocoles. En surmontant les obstacles techniques, ce projet ambitionne de faire de Gm un modèle de référence pour la recherche, tout en minimisant l'utilisation d'animaux vertébrés.
Projet est porté par : Yoann AUGAGNEUR.
Financement attribué :
Le projet Optimello se voit attribuer un financement de 48 500 €.
ReMiRa : Développement de substituts cellulaires adaptés et applicables en routine aux activités en lien avec la rage.
Résumé :
La rage, infection virale toujours mortelle, reste un problème majeur de santé publique dans le monde, avec environ 59 000 décès humains annuels après transmission par des animaux infectés. Un diagnostic de laboratoire précis est donc essentiel pour confirmer la maladie chez l’animal, évaluer sa distribution, mais aussi prendre en charge les personnes potentiellement exposées. Actuellement, les échantillons servant aux comparaisons inter-laboratoires, tout comme les contrôles positifs de laboratoire, sont obtenus sur des souris infectées expérimentalement. Compte-tenu des progrès considérables observés dans la production et l’utilisation de systèmes cellulaires 3D, nous proposons de développer des modèles de laboratoire adaptés et spécifiques pour réduire et remplacer l’utilisation de souris pour la production de virus rabique, la collecte de matériel infecté, l'isolement viral et les études de physiopathologie.
Projet est porté par : Marine WASNIEWSKI.
Financement attribué :
Le projet ReMiRa se voit attribuer un financement de 48 500 €.
3D-DISC : Developpement d'un modele 3d de disque intervertebral pour l'évaluation de thérapies régénératrices.
3D-MICROTECH : Promouvoir l’Hétérogénéité Microenvironnementale en Culture Cellulaire 3D : Approches Techniques et Formation.
A-CELLHERD : Réalisation d'un troupeau cellulaire de cellules souches pluripotentes porcines pour des approches de génétique cellulaire.
Résumé :
Le mal de dos, principale cause d'invalidité à l'échelle mondiale, est principalement liée à la dégénérescence des disques intervertébraux. Les traitements actuels, tels que anti-douleurs et approche chirurgicale, ne traitent pas les processus biologiques dégénératifs. A l’inverse, la médecine régénératrice vise à ralentir ces processus et à rétablir un disque sain. Afin de réduire l’utilisation de modèle animaux pour l’évaluation de ces nouvelles thérapies, le projet 3D-DISC va développer un modèle de disque intervertébral grâce à la technologie de biofabrication. Nous comparerons dans ce modèle in vitro la capacité de cellules et de vésicules extracellulaires à ralentir le processus de dégénerescence.
Projet porté par : Catherine LE VISAGE
Financement attribué :
Le projet 3D-DISC se voit attribuer un financement de 48 500 €.
Résumé :
Deux-tiers des molécules candidates anticancéreuses qui fonctionnent chez la souris échouent lors des essais sur les humains. De plus, la résistance aux traitements pourtant validés reste un défi majeur chez les patients. La solution à ces problèmes est en grande partie liée à la possibilité de reproduire l’hétérogénéité du cancer originel, avec des zones tumorales non identiques qui favorisent l’agressivité des tumeurs. Notre projet innovateur porte (1) sur le développement de modèles de culture de cellules humaines qui reproduisent l’hétérogénéité tumorale en agissant sur l’environnement dans lequel les cellules cancéreuses subsistent, et (2) sur une formation théorique et pratique sur la production de tumeurs au laboratoire qui sont conformes à la réalité. Ce projet sera valorisé dans le monde scientifique et clinique tout en respectant le monde animal.
Projet porté par : Sophie LELIèVRE
Financement attribué :
Le projet 3D-MICROTECH se voit attribuer un financement de 48 500 €.
Résumé :
Les changements globaux actuels nous obligent à repenser nos systèmes d’élevage pour réduire la pression sur les écosystèmes, augmenter la sécurité alimentaire et sanitaire et mieux prendre en considération le bien-être animal. Pour cela, nous utilisons des leviers (génétique, nutritionnel ou environnementaux) qui nous permettent de mieux adapter les animaux d’élevage à ces nouveaux objectifs. Mais pour les actionner efficacement, il est nécessaire de pouvoir prédire leurs effets sur les animaux. Pour cela et afin d’éviter de recourir à des prélèvements invasifs et à l’expérimentation animale, nous proposons de remplacer les animaux par des troupeaux de lignées cellulaires pluripotentes. Ces cellules permettent de produire in vitro différents tissus et mini-organes et facilitent notamment l’étude des caractères de santé ou de nutrition en lien avec les facteurs génétiques, nutritionnels et environnementaux.
Projet porté par : Hervé ACLOQUE
Financement attribué :
Le projet A-CELLHERD se voit attribuer un financement de 39 000 €.
Adiponet : Organoïdes de tissus adipeux humain: Développement et Standardisation des méthodes de congélation/décongélation et mise en culture pour les biobanques.
CARDIOCELL : Les cellules iPSC dérivées de cardiomyocytes de patients : un nouveau modèle cellulaire pour le traitement de la dysfonction sinusale.
CellMorphTox : Morphologie cellulaire pour évaluer le risque de toxicité d’une molécule chimique.
Résumé :
Les maladies métaboliques et les maladies inflammatoires chroniques de l’intestin ont conquis le monde ces dernières décennies, avec l’occidentalisation du mode de vie et des habitudes alimentaires. Un facteur commun à ses pathologies serait le rôle joué par le tissu adipeux dans le contrôle du métabolisme et l’inflammation dans ses pathologies. La recherche utilise des milliers de souris chaque année pour élucider ce rôle, mais on sait que le tissu adipeux de ces animaux est différent de celui de l’Homme. Le projet AdipoNet vise à créer une procédure pour congeler/décongeler du tissu adipeux humains permettant son transport et les échanges entre laboratoires, mais aussi la culture de tissu adipeux à partir de tissus de patients décongelés, et l’établissement de biobanques pour la recherche médicale à partir de ces cultures.
Projet porté par : Anne BOULOUMIE
Financement attribué :
Le projet Adiponet se voit attribuer un financement de 48 500 €.
Résumé :
Pour les chercheurs, la technologie des cellules souches humaines pluripotentes induites (IPS) constitue un outil unique pour modéliser et étudier certaines pathologies. Cette approche consiste à faire différencier, in vitro, des cellules IPS en différents types cellulaires. Elle présente l’immense avantage de reproduire une pathologie dans une boite de Pétri sans avoir recours aux modèles animaux. Notre objectif principal est d’utiliser ce modèle unique de pathologie « en boite de pétri » pour comprendre le génome du patient, son fonctionnement cellulaire afin d’identifier de nouvelles approches thérapeutiques pour traiter la dysfonction sinusale symptomatique. Cette pathologie cardiaque est la forme la plus commune de bradycardie. Chaque année, elle induit l’implantation de plus de 500 000 pacemakers électroniques en Europe et aux Etats-Unis.
Projet porté par : Pietro MESIRCA
Financement attribué :
Le projet CARDIOCELL se voit attribuer un financement de 48 500 €.
Résumé :
Grâce à des techniques innovantes d’imagerie de cellules marquées par fluorescence, telles que la ‘Cell Painting’, il est possible d’analyser les changements morphologiques des cellules induits par l’exposition à une molécule chimique, de façon systématique, ouvrant la voie à des campagnes de criblages de librairies de composés chimiques. Dans ce cadre, le projet CellMorphTox vise à collecter ce type de données et développer une méthode informatique permettant d’identifier une ‘signature’ de morphologie cellulaire pour un ensemble de composés partageant un même profil phénotypique néfaste pour la santé humaine. Cet outil sera accessible à la communauté scientifique via une plateforme en ligne et contribuera à réduire des tests sur animaux, en suivant les principes des 3R (Remplacement, Réduction, Raffinement). Il pourra guider les autorités dans l’évaluation des risques chimiques futurs.
Projet porté par : Olivier TABOUREAU
Financement attribué :
Le projet CellMorphTox se voit attribuer un financement de 48 500 €.
FELINT : Nouveaux modèles cellulaires pour mieux comprendre les interactions spécifiques entre T. gondii et son hôte définitif félin.
GlioTumoroids : Organoïdes cortico-endothéliaux humains pour l'étude in vitro de la physiopathologie du glioblastome.
Habemuscl : Plateforme préclinique avancée basée sur l'humain pour la modélisation des maladies neuromusculaires.
Résumé :
La toxoplasmose est une maladie zoonotique qui a des conséquences graves chez les immunodéprimés et le fœtus lors de primo-infection chez la femme enceinte. Le parasite responsable, Toxoplasma gondii, peut infecter tous les animaux à sang chaud mais c’est uniquement chez le chat qu’a lieu sa reproduction sexuée, aboutissant à l’excrétion fécale de parasites infectieux dans l’environnement, responsables de contaminations animales et humaines. Ainsi, il est essentiel d’élaborer de nouvelles stratégies efficaces contre cette infection chez les chats afin de bloquer l’excrétion du parasite et protéger ainsi l’environnement et la santé publique. Notre projet de recherche propose de développer puis d’utiliser de nouvelles approches de culture cellulaire alternatives à l’utilisation d’animaux, pour augmenter les connaissances sur le cycle de vie de T. gondii chez le chat dans cette perspective.
Projet porté par : Delphine LE ROUX
Financement attribué :
Le projet FELINT se voit attribuer un financement de 35 000 €.
Résumé :
Le glioblastome (GB) est une tumeur cérébrale agressive à pronostic défavorable, dont les interactions avec l’environnement cellulaire du cerveau restent mal comprises. Traditionnellement, l’étude du GB repose sur des modèles murins, une approche coûteuse, chronophage et soulevant des questions éthiques. Ce projet propose une alternative in vitro innovante: un système organoïde combinant des cellules corticales et endothéliales humaines (CO+EO), qui reproduit les tissus cérébraux vascularisés. Grâce à ce modèle, nous étudierons l’interaction des cellules GB avec différents types de tissus et le rôle du gène CELF2 dans l’agressivité tumorale. Cette recherche vise à décrypter les mécanismes moléculaires influençant la migration et la croissance du GB, ouvrant la voie à de nouveaux traitements tout en réduisant l’utilisation de modèles animaux.
Projet porté par : Michele BERTACCHI
Financement attribué :
Le projet GlioTumoroids se voit attribuer un financement de 48 500 €.
Résumé :
Les maladies neuromusculaires (MNM), telles que les dystrophies musculaires, manquent de modèles précliniques efficaces pour étudier leurs mécanismes et tester les traitements. Bien que les modèles animaux aient été utilisés pendant des décennies, ils ne reflètent pas toujours fidèlement les conditions humaines, ce qui entraîne des échecs dans les essais cliniques. Les modèles cellulaires humains sont une alternative prometteuse, mais leur maturation est souvent insuffisante. Ce projet vise à créer une plateforme avancée, humaine, pour modéliser les tissus musculaires. En combinant cultures cellulaires 2D et 3D avec stimulations électriques et mécaniques, nous développerons un dispositif tout-en-un pour l'analyse des modèles musculaires, utilisés pour l’étude des MNM, les tests de médicaments et la médecine personnalisée, réduisant ainsi le besoin de modèles animaux et les coûts de la recherche.
Projet porté par : Stefano TESTA
Financement attribué :
Le projet Habemuscl se voit attribuer un financement de 45 000 €.
HOBIT : Rythme biologique intrinsèque des organoïdes hépatiques.
ICOPRIM : Optimisation des organoïdes cérébelleux pour une modélisation robuste de pathologies.
MINIBRAIN : Modéliser les neurodégénérescences humaines sur puce pour réussir le transfert clinique de candidats médicaments.
Résumé :
Les rythmes circadiens jouent un rôle physiologique central et proviennent de l'horloge circadienne (HC) présente dans toutes les cellules du corps. Perturbée dans les maladies métaboliques, l’HC est essentielle à la santé du foie. Les cellules souches pluripotentes humaines induites (hiPSCs) dérivées en organoïdes hépatiques apparaissent comme une alternative expérimentale afin d’améliorer la transférabilité des résultats précliniques à l'Homme. Cependant, nous ne connaissons rien de leurs propriétés circadiennes. En utilisant un protocole exempt de dérivés animaux, notre projet caractérisera précisément les caractéristiques temporelles et circadiennes des hiPSCs dérivées en organoïdes hépatiques synchronisés. Ce projet (1) rendra les organoïdes hépatiques plus pertinent d'un point de vue physiologique, (2) réduira le nombre d'animaux utilisés dans la recherche pharmacologique et (3) sera un grand atout pour améliorer la médecine de précision et personnalisée.
Projet porté par : Daniel MAUVOISIN
Financement attribué :
Le projet HOBIT se voit attribuer un financement de 48 500 €.
Résumé :
Le cervelet, connu pour son rôle dans la coordination motrice, joue également un rôle essentiel dans la mémoire, le langage et les émotions. Les malformations congénitales du cervelet sont associées à divers troubles neurodéveloppementaux, qui constituent le cœur de notre recherche. Malgré les progrès en génétique, de nombreux cas restent inexpliqués et aucune thérapie n’est actuellement disponible. Pour y remédier, nous développons des modèles in vitro issus de cellules souches, appelés organoïdes, qui imitent le développement précoce du cervelet humain. Notre projet vise à accroître la fiabilité, la précision et la robustesse de ces modèles et en faire une alternative aux modèles animaux, pour mieux comprendre maladies du cervelet et ouvrir la voie à des thérapies ciblées.
Projet porté par : Marion COOLEN
Financement attribué :
Le projet ICOPRIM se voit attribuer un financement de 48 500 €.
Résumé :
Les maladies neurodégénératives atteignent des niveaux épidémiques dans les pays industrialisés, affectant déjà plus de 7 millions de personnes en Europe. Et pourtant, il n’existe toujours aucune thérapie efficace. Le développement de médicaments fait face à des défis majeurs, car les tests traditionnels sur animaux ont une faible valeur prédictive pour l’Homme. Les progrès sur les cellules souches humaines, combinés aux microsystèmes organes-sur-puce, offrent de nouvelles perspectives très prometteuses. En reproduisant un tissu humain à l’échelle microscopique, ces systèmes améliorent la pertinence physiologique des modèles actuels, tout en offrant des alternatives crédibles à l’expérimentation animale. Notre laboratoire est pionnier dans la conception de modèles cerveau-sur-puce. Le projet MINIBAIN propose désormais de développer une nouvelle génération de dispositifs humanisés, pour une recherche pharmaceutique plus efficace et plus éthique.
Projet porté par : Maxime CAZORLA
Financement attribué :
Le projet MINIBRAIN se voit attribuer un financement de 47 000 €.
OBANI : Obtention d’anticorps pour l’immunohistochimie et le western blotting sans animaux.
Optimello : Optimiser l’utilisation de la larve Galleria mellonella comme modèle alternatif d’infection pour des bactéries pathogènes.
ReMiRa : Développement de substituts cellulaires adaptés et applicables en routine aux activités en lien avec la rage.
Résumé :
Le phage display : une méthode innovante pour développer des anticorps spécifiques Le phage display est une technologie moderne qui permet de produire rapidement des anticorps ciblant des protéines dénaturées, comme celles analysées en immunohistochimie ou western blot. Elle utilise des bactériophages (virus) modifiés pour afficher des anticorps à leur surface, permettant une sélection directe et précise contre les épitopes linéaires des protéines dénaturées. Cette méthode est rapide, évite l’utilisation d’animaux, et offre une grande flexibilité pour s’adapter aux conditions expérimentales spécifiques. Les anticorps ainsi générés sont hautement spécifiques, efficaces, et peuvent être optimisés pour répondre aux besoins de la recherche ou du diagnostic. Le phage display est donc une solution éthique et puissante pour développer des outils fiables et adaptés à la détection des protéines en milieu dénaturant.
Projet porté par : Pierre MARTINEAU
Financement attribué :
Le projet OBANI se voit attribuer un financement de 48 500 €.
Résumé :
Le projet Optimello explore le potentiel de Galleria mellonella (Gm) comme alternative aux animaux vertébrés dans la recherche sur les infections bactériennes. Respectant les principes des 3R (Remplacer, Réduire, Raffiner), ce modèle facile à maintenir est rentable, éthique et évolutif. Gm présente un système immunitaire inné similaire à celui des humains. Optimello vise trois objectifs : produire un génome de Gm complet et annoté, établir une carte des interactions hôte-pathogène via des études transcriptomiques, et créer une plateforme en ligne pour partager les données et standardiser les protocoles. En surmontant les obstacles techniques, ce projet ambitionne de faire de Gm un modèle de référence pour la recherche, tout en minimisant l'utilisation d'animaux vertébrés.
Projet porté par : Yoann AUGAGNEUR
Financement attribué :
Le projet Optimello se voit attribuer un financement de 48 500 €.
Résumé :
La rage, infection virale toujours mortelle, reste un problème majeur de santé publique dans le monde, avec environ 59 000 décès humains annuels après transmission par des animaux infectés. Un diagnostic de laboratoire précis est donc essentiel pour confirmer la maladie chez l’animal, évaluer sa distribution, mais aussi prendre en charge les personnes potentiellement exposées. Actuellement, les échantillons servant aux comparaisons inter-laboratoires, tout comme les contrôles positifs de laboratoire, sont obtenus sur des souris infectées expérimentalement. Compte-tenu des progrès considérables observés dans la production et l’utilisation de systèmes cellulaires 3D, nous proposons de développer des modèles de laboratoire adaptés et spécifiques pour réduire et remplacer l’utilisation de souris pour la production de virus rabique, la collecte de matériel infecté, l'isolement viral et les études de physiopathologie.
Projet porté par : Marine WASNIEWSKI
Financement attribué :
Le projet ReMiRa se voit attribuer un financement de 48 500 €.