
Les citoyens européens contre l’expérimentation animale

L ’initiative citoyenne européenne (ICE) propose le renforcement de l’interdiction du recours aux animaux pour les cosmétiques, mais aussi qu’elle soit étendue aux produits chimiques et à la recherche en général.
L’initiative citoyenne européenne (ICE) « Save Cruelty Free Cosmetics – Commit to a Europe Without Animal Testing », qui a reçu le soutien de plus d’un million de citoyens européens, a été soumise à la Commission fin janvier 2023. En tant que partie de sa réponse, la Commission a organisé, les 11 et 12 décembre 2023, un workshop regroupant des législateurs, des représentants d’associations, et des scientifiques, pour permettre de discuter des différentes étapes nécessaires à l’élaboration d’une feuille de route pour remplacer les tests animaux lors des évaluations de sécurité des produits chimiques (effets sur la santé humaine, sur l’environnement...).
Contextualisation de la feuille de route
Suite à l’introduction du projet, les différents acteurs ont pu donner leurs points de vue et attentes concernant la feuille de route. A travers de courtes présentations, ils ont partagé l’état de l’art dans leurs domaines, évoqué les projets en cours, et souligné les points clefs nécessitant une réflexion approfondie.
Jay Ingram, de Humane Society International, l’une des organisations non gouvernementales (ONG) initiatrice de l’ICE, a mis en avant la nécessité de questionner les cadres réglementaires existants et d’adopter une perspective holistique sur la protection de la santé humaine et environnementale. Il a également soulevé la problématique de la sémantique de l’acronyme « NAMs » - qui peut référer à « New Approach Methodologies » au sens originel, ou à « Non-Animal Methods » (de plus en plus utilisé, y compris dans d’autres domaines que la toxicologie) - mettant en lumière l’importance des termes pour une communication efficace.
Carl Westmoreland, directeur de la Science et Technologie dans la division Sécurité de l’Environnement à Unilever, a présenté l’initiative « NAMs Designathon » de l’EPAA (European Partnership for Alternative Approaches to Animal Testing) qui vise à exploiter les données issues des NAMs pour classer les produits chimiques selon leur risque de toxicité systémique pour l’humain. Cette classification serait basée sur 2 critères :
-
la toxicodynamique intrinsèque : l’activité toxique potentielle du composé (morphologie cellulaire, transcriptomique, etc)
-
les propriétés toxicocinétiques : la biodisponibilité du composé après exposition (Absorption, Distribution, Métabolisation, Élimination, cinétique basée sur la physiologie PBK, etc) pour permettre de refléter le « niveau de préoccupation » (Élevé, Moyen ou Faible) associé à chaque produit chimique.
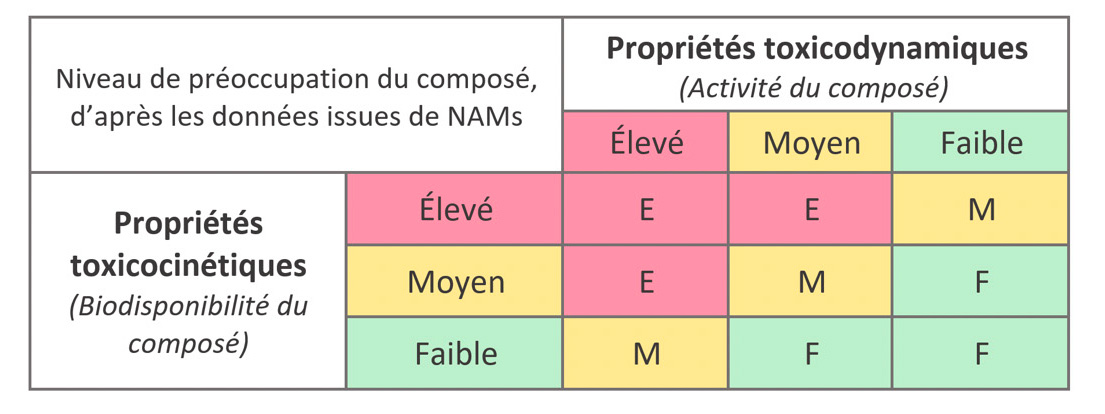
Une étude-pilote sur 150 composés chimiques est en cours pour affiner cette classification et un workshop aura lieu prochainement entre participants à cette étude , pour comparer les différentes méthodes et identifier quelles NAMs permettent de mieux classifier les divers types de produits chimiques.
Adam Lilicrap, directeur de recherche en écotoxicologie et évaluation du risque à l’Institut Norvégien pour la Recherche sur l’Eau (NIVA) s’est penché sur l’utilisation intensive des poissons pour des tests de toxicité aquatique pour la protection de l’environnement. Le test OECD TG 203, utilise la mort comme critère de toxicité aigüe. Il existe déjà des méthodes de remplacement telles que le test OECD TG 249 sur lignée cellulaire de branchies de truite arc-en-ciel « RTgill », validé en 2021, ou les outils QSAR (relation quantitative entre structure & activité). Une autre méthode - OECD TG 236 - se base sur l’utilisation d’embryons de poissons plutôt que d’adultes. Adam Lilicrap a souligné également les limites des tests d’écotoxicologie qui, réalisés sur quelques espèces uniquement, ne sont pas représentatifs de l’environnement dans sa globalité.
Focus sur les aspects réglementaires
Une mise en lumière des aspects réglementaires a permis d’avoir une réflexion sur les méthodes de travail. L’accent a été mis sur les processus de validation des NAMs, d’établissement de la confiance et sur l’acceptation réglementaire des NAMs. Elle a soulevé la question de savoir si les différents outils réglementaires (législatifs, OCDE…) peuvent encore refléter correctement l’état actuel de la science.
Christophe Rousselle, évaluateur des risques sanitaire à l’ANSES, a partagé son expérience et sa perspective de l’utilisation des NAMs dans l’évaluation du risque. Il a souligné l’importance de fournir des données transparentes et détaillées sur la reproductibilité, la sensibilité, et la spécificité des NAMs, lors d’un dépôt de dossier. Actuellement manquantes, ces informations permettraient d’instruire les évaluateurs et d’instaurer une confiance solide envers les NAMs. Étant coordinateur adjoint du projet PARC (Partenariat pour l'évaluation des risques liés aux produits chimiques), il a présenté l’implication de l’ANSES dans ce projet, et notamment dans le « Work Package 5 » qui est spécifiquement dédié à l’évaluation des dangers grâce aux NAMs.
João Barroso, responsable scientifique au sein de l’EURL ECVAM, a évoqué les différents aspects et points d’évolution du document GD34 de l’OCDE, qui guide la validation et l’acceptation internationale de nouvelles méthodes pour l’évaluation du risque. En effet, rédigé il y a 20 ans, ce document ne reflète plus l’état de l’art de la science actuelle. Les principaux axes de la révision comprendront les validations des « Defined Approaches », l’intégration de guides pratiques sur la validation, la définition du concept de validation technique, l’évaluation de la pertinence d’une NAM ou encore les validations d’intelligence artificielle ou d’organes-sur-puces. La version révisée du document devrait être discutée au sein de l’OCDE en avril 2025.
L’harmonisation du langage, la définition précise des objectifs, la collaboration et communication internationale, l’examen du contexte réglementaire ainsi que les aspects de la validation des NAMs seront les éléments clefs de la feuille de route. Il est donc clair qu’un changement de paradigme, aussi bien sociétal que réglementaire, est nécessaire à l’implémentation de ces méthodes découlant d’une science en constante évolution.
Un prochain workshop prévu fin 2024 permettra d’évaluer les progrès réalisés dans le développement de cette feuille de route.
