A regarder

Le 18 janvier 2024, le FC3R a organisé un webinaire sur les modèles organoïdes et leurs applications dans la recherche. Regardez-le en replay !
L'Institut Jacques Monod à Paris a accueilli le 29 janvier 2024 un symposium consacré à l'exploration du monde des organoïdes neuraux corticaux et spinaux, qui constituent des outils puissants pour l'étude de la biologie des neurones et la modélisation de diverses maladies du cerveau. Ce symposium organisé par la plateforme enSCORE, avec le soutien du DIM C-BRAINS, de l'Université Paris Cité, du Labex " Who Am I ? " de l'Institut Jacques Monod, du GDR Organoïdes, de Vizgen, de Stemcell technologies et de Medchemexpress, a offert aux chercheurs une occasion unique de présenter leurs travaux, de développer des collaborations et de découvrir les dernières avancées dans ce domaine.
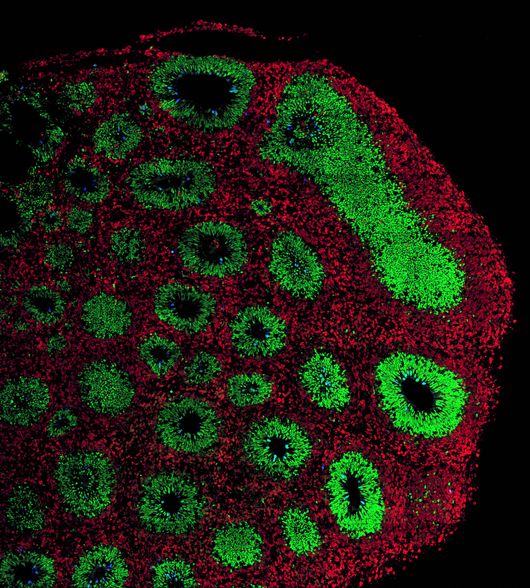
Des organoïdes pour comprendre et combattre les maladies neurologiques
Les organoïdes se révèlent essentiels pour élucider les complexités des maladies du cerveau, comme en a témoigné le nombre de présentations et de posters sur le sujet.
-
Par exemple, Benjamin Galet (Institut du Cerveau, Paris) utilise des organoïdes cérébraux pour étudier l'implication des longs ARN non-codants dans la physiopathologie de la maladie d'Alzheimer.
-
Des organoïdes dérivés d'iPSC ont permis à l'équipe de Miria Ricchetti (Institut Pasteur, Paris) de comprendre que l'altération de l'expression des gènes en fonction du stress oxydatif et nitrosatif joue probablement un rôle majeur dans le syndrome de Cockayne, ouvrant ainsi la voie au développement de nouvelles thérapies pharmacologiques.
-
Les organoïdes sont également très utiles pour étudier les maladies neurodéveloppementales, telles que le syndrome de Joubert : Ludovica Brunetti (Institut de Biologie Paris-Seine) développe des organoïdes à partir de cellules de patients afin d'identifier les gènes qui sont exprimés de manière différentielle dans la maladie, et combine cette approche avec des tests pharmacologiques pour la découverte de nouveaux médicaments.
Reproduire la complexité du système nerveux
Des protocoles standardisés permettent déjà le développement d'organoïdes hautement reproductibles, spécifiques à une région du cerveau. Il est alors possible de les combiner en « assembloïdes » pour connecter différentes régions du système nerveux. Mais on assiste également à l'émergence d'organoïdes multirégionaux :
-
Michele Bertacchi (Institut de Biologie Valrose, Nice) a montré comment FGF8 peut influencer l'identité régionale, ce qui permet d'obtenir des organoïdes cérébraux humains contenant des domaines télencéphaliques, diencéphaliques et mésencéphaliques.
-
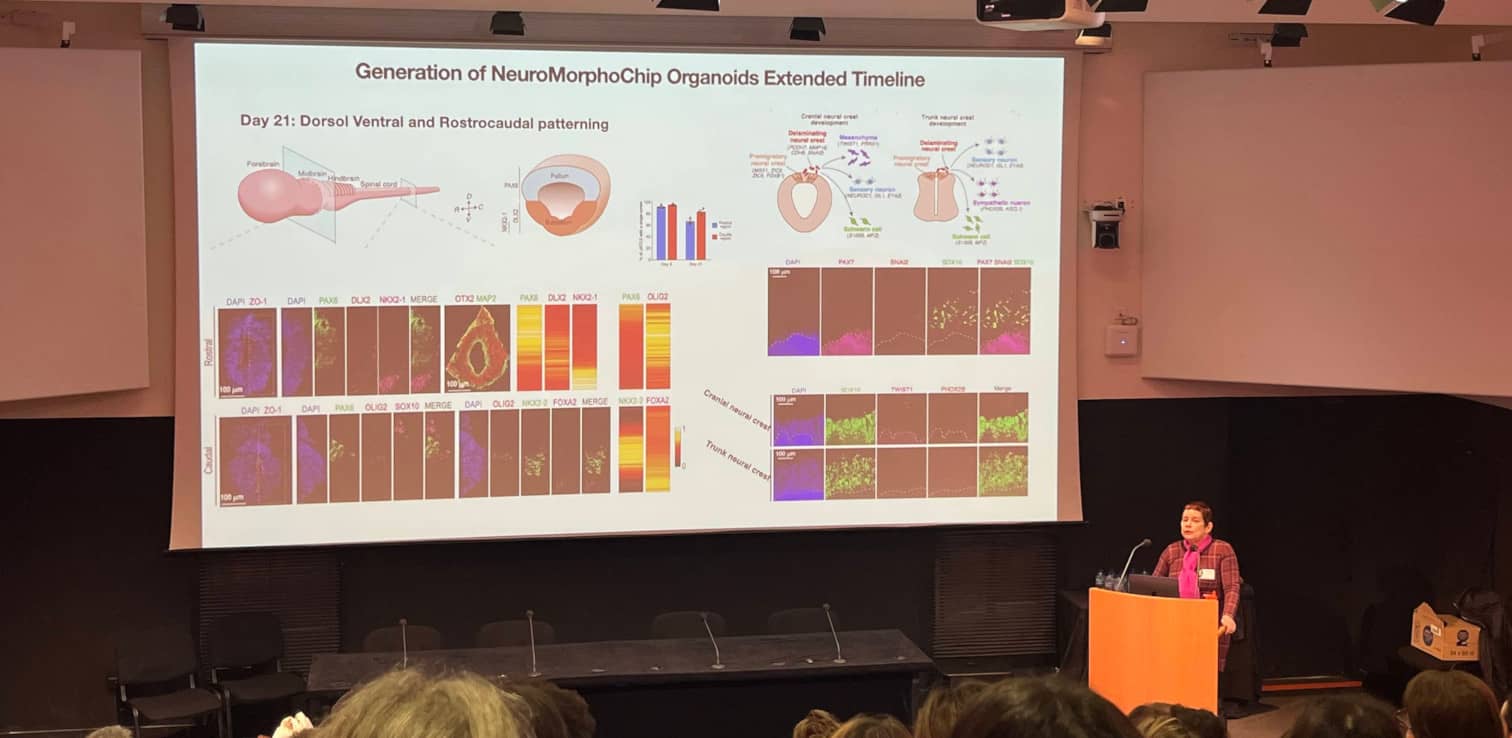
Orly Reiner (Weizmann Institute of Science, Israël) a présenté les organoïdes NeuroMorphoChip : des organoïdes de tube neural dérivés de cellules souches pluripotentes humaines, qui récapitulent l’organisation rostro-caudale du système nerveux central (SNC). Pour générer ces organoïdes NeuroMorphoChip, les cellules sont exposées sur puce microfluidique à différents gradients de morphogènes, ce qui entraîne une polarisation cellulaire, la formation d'un tube avec un lumen avec un patron rostro-caudal, suivi d'un patron dorso-ventral du "cerveau antérieur". Après 21 jours de développement, des cellules de crêtes neurales du crâne et du tronc apparaissent également. Le modèle peut être combiné avec des mutations pour étudier l'effet de gènes spécifiques sur les maladies neurodéveloppementales, telles que la microcéphalie.
-
Le laboratoire de Stéphane Nedelec (Institut du Fer à Moulin, Paris) a réussi à induire l'élongation axiale et la différenciation neuro-mésodermique d'agrégats de cellules pluripotentes humaines, pour générer des "spinoïdes" (organoïdes spinaux) composés d'un tube neural entouré de somites segmentés. Au fil du temps, les neurones se différencient en sous-type selon le schéma antéro-postérieur, et les somites donnent naissance à des progéniteurs musculaires qui sont en contact avec les projections neurales, créant ainsi un système de tronc intégré complexe pour étudier l'émergence des circuits sensori-moteurs.
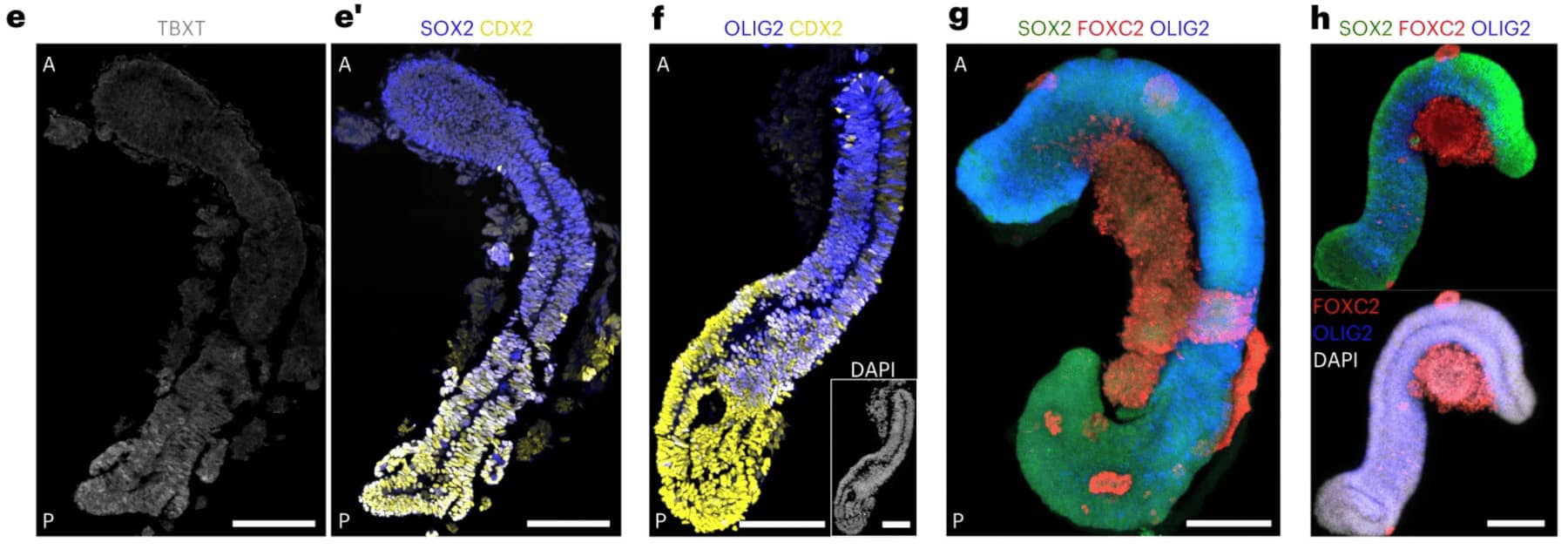
© Gribaudo et al., 2023. « Spinoïdes » développés dans le laboratoire de Stéphane Nedelec
Prochaines étapes : immuno-compétence et vascularisation fonctionnelle ?
Pour améliorer la complexité des organoïdes neuraux, les chercheurs étudient l'ajout d'autres types de cellules, telles que des cellules immunitaires (microglie) et des cellules endothéliales.
-
Hariam Raji (Institut Imagine, Paris) développe un modèle d'organoïde de cerveau moyen pour la maladie de Parkinson à partir de cellules humaines, avec des caractéristiques pathologiques telles que l'accumulation d'alpha-synucléine et la perte progressive de neurones dopaminergiques, et les met en co-culture avec des microglies dérivées d'iPSC afin d'étudier l'activation microgliale et la réponse pro-inflammatoire. Les cellules microgliales colonisent le tissu rapidement et efficacement et sont capables de survivre dans l'organoïde cérébral pendant au moins deux mois. Pour assurer une bonne diffusion de l'oxygène dans le tissu, ces organoïdes sont également cultivés dans un bioréacteur rotatif à agitation, ce qui permet d'améliorer la qualité, la maturation et la différenciation du tissu organoïde.
-
Une autre façon d'assurer une bonne oxygénation des tissus et de permettre le maintien et la croissance à long terme des organoïdes serait de développer une vascularisation dans ces modèles. Loïc le Guennec (Institut Cochin, Paris) développe des organoïdes cérébraux humains vascularisés avec une barrière hémato-encéphalique pour étudier la dissémination des métastases dans le cerveau au cours de la leucémie lymphoblastique aiguë à cellules T. Même si de telles co-cultures sont déjà un succès, la difficulté réside toujours dans la capacité à modéliser une vascularisation correctement connectée, continue et étanche.
Bien qu'il reste des défis à relever pour générer des modèles cérébraux complexes, le symposium a mis en évidence l'immense potentiel des organoïdes neuraux, qui permettent de plus en plus de reproduire la complexité des organes in vivo. Ces modèles offrent déjà des possibilités sans précédent pour l'étude de processus biologiques et développementaux auparavant inaccessibles, tels que la pathomorphologie et le comportement de neurones vivants dérivés de patients, ou les premières étapes de la neurogenèse. L'avenir promet de belles avancées dans ce domaine passionnant.
